Valenzelektronen – Was ist das?
Die Elektronen befinden sich in der Atomhülle. Die Atomhülle ist in jedem Atom in verschiedene Schalen unterteilt. Die Elektronen in der äußersten Schale heißen Außenelektronen oder Valenzelektronen. Diese Elektronen spielen in der Chemie eine sehr wichtige Rolle. Sie sind für Reaktionen und die Bildung neuer Verbindungen entscheidend.
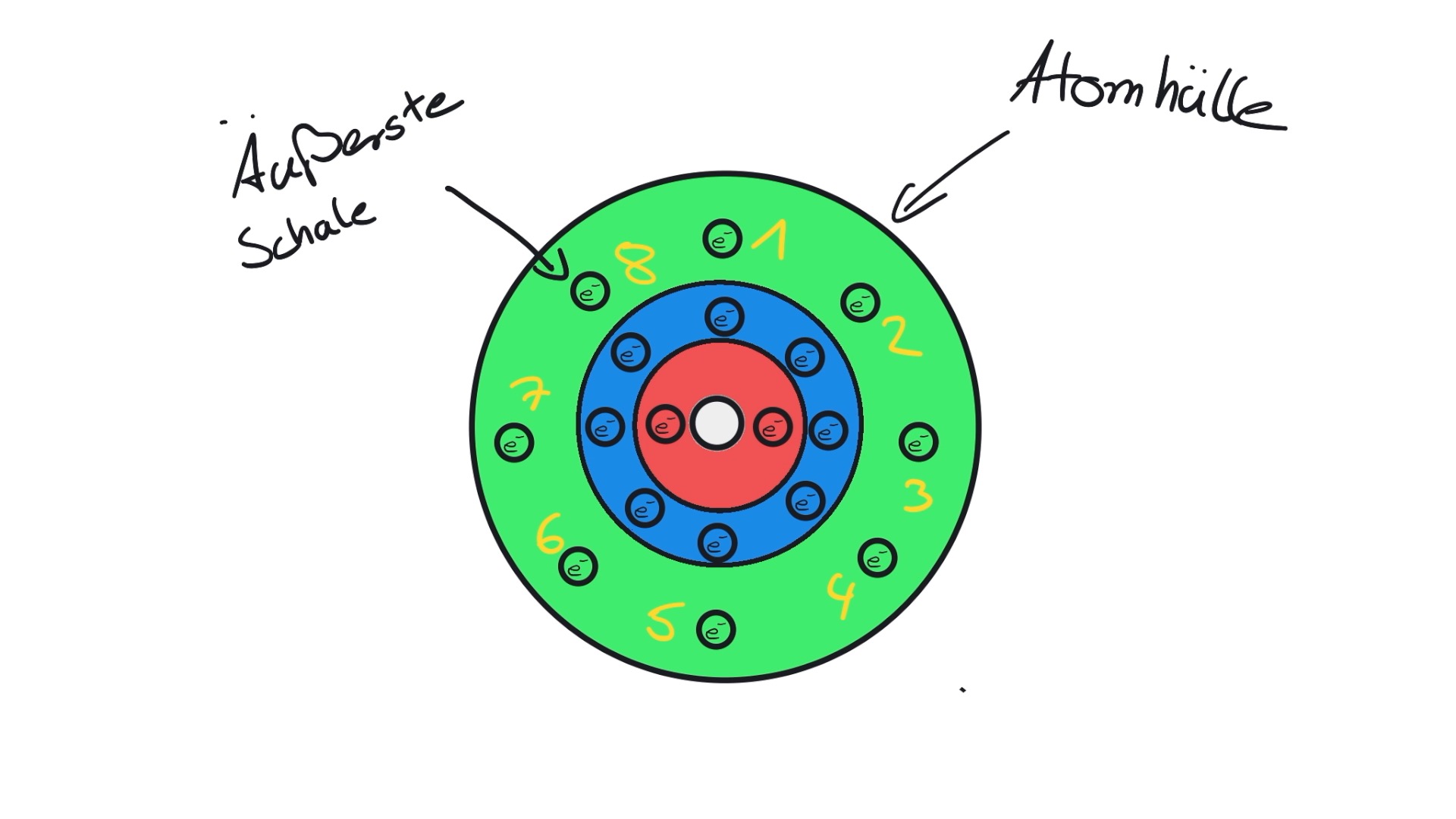
Oktett-/Edelgasregel und Edelgaskonfiguration
Die Edelgase kannst du in der 8. Hauptgruppe des Periodensystems finden. Sie haben meist acht Valenzelektronen. Die äußerste Schale ist damit voll besetzt. Aufgrund dieser Besonderheit kann man die sogenannte Oktettregel festlegen. Die Oktettregel besagt, dass Atome mit einer vollen Außenschale sehr stabil sind. Die Oktettregel kann auch Edelgasregel genannt werden.
Hier kannst du dir das Periodensystem anschauen. Kannst du die Edelgase finden? Sie sind in der 8. Hauptgruppe.
Natürlich gibt es auch Ausnahmen: In der 1. Schale der Atomhülle können sich nur maximal zwei Elektronen befinden.
Helium ist auch ein Edelgas. Es ist besonders stabil, weil die Außenschale vollständig besetzt ist. Aber nur mit zwei Elektronen und nicht mit acht, wie bei den anderen Edelgasen. Trotzdem können wir hier auch sagen, dass Helium die Oktettregel erfüllt.
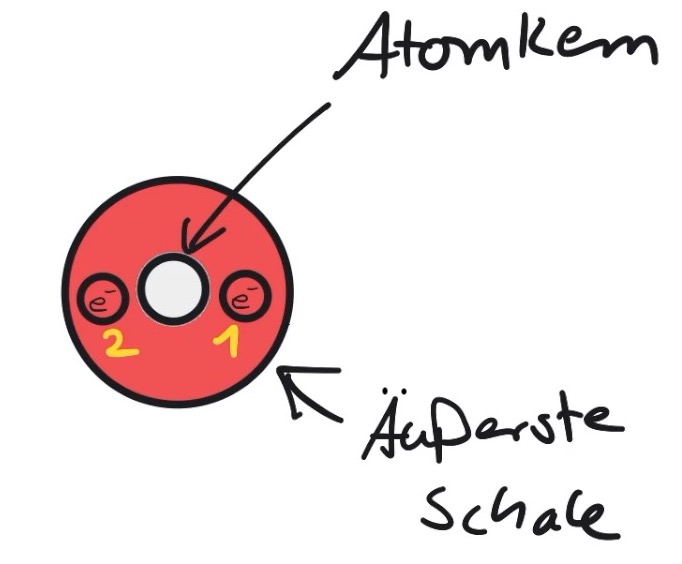 Abbildung 2: Aufbau eines Heliumatoms. Die äußerste Schale ist mit zwei Valenzelektronen vollständig besetzt.
Abbildung 2: Aufbau eines Heliumatoms. Die äußerste Schale ist mit zwei Valenzelektronen vollständig besetzt.
Das Wort „edel“ können wir in diesem Zusammenhang auch als „stabil‘‘ verstehen. Auch andere Elemente können durch chemische Reaktionen eine volle Außenschale bekommen. Dann wird die sogenannte Edelgaskonfiguration erreicht.